[177Lu]Lu-PSMA-617 frente a la observación en el cáncer de próstata oligometastásico positivo para PSMA (PSMA-DC) NCT05939414
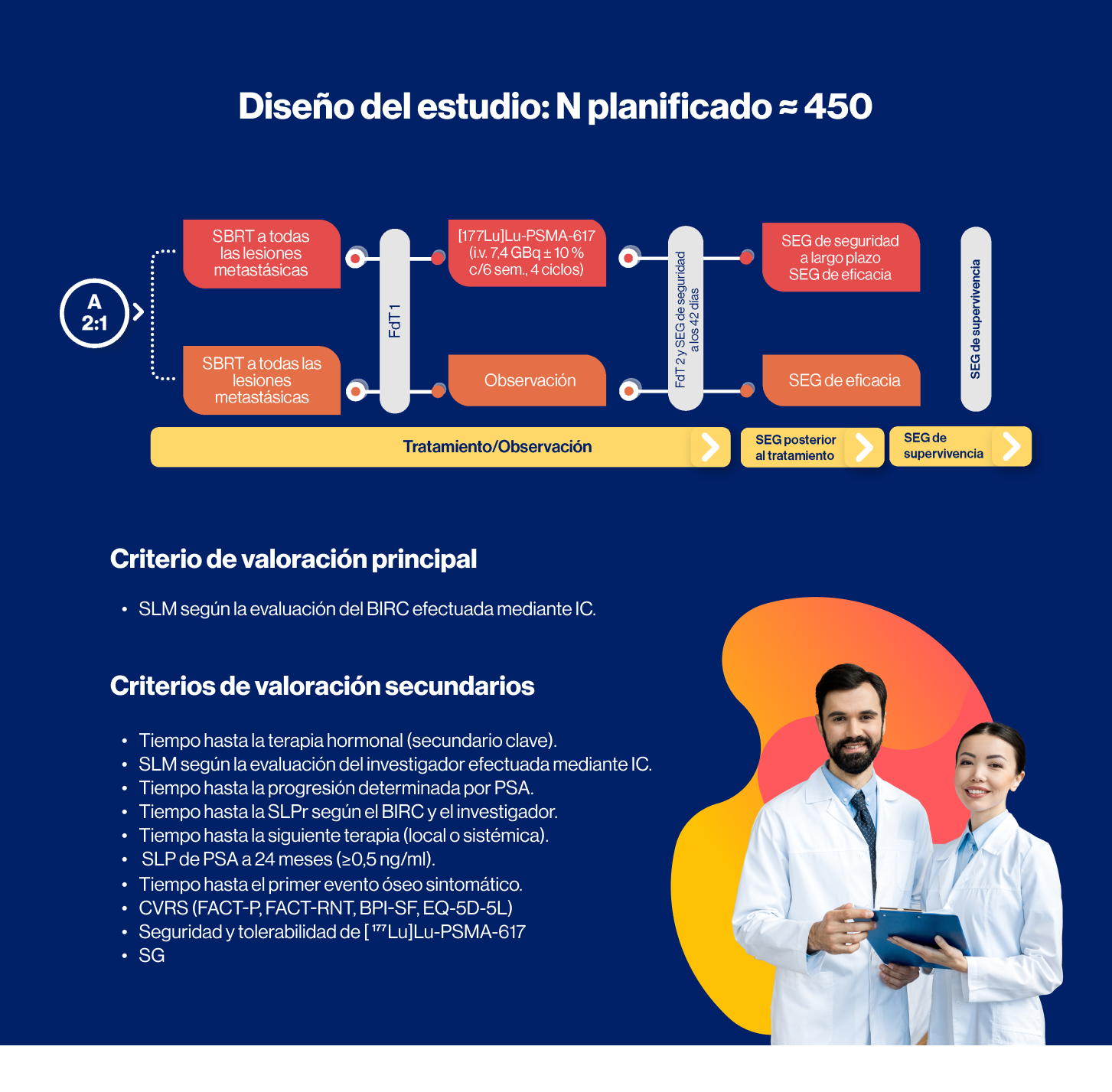
Estudio internacional, prospectivo, abierto, multicéntrico, aleatorizado, de fase III destinado a comparar [177Lu]Lu-PSMA-617* frente a la observación para retrasar la castración o la recurrencia de la enfermedad en pacientes adultos de sexo masculino con CPOM positivo para PSMA1,2

Criterios de elegibilidad clave:
- Adultos ≥18 años con CP histológicamente confirmado.
- Estado funcional ECOG de 0 a 1.
- Enfermedad bioquímicamente recurrente tras el tratamiento definitivo para la próstata por PR, o RTX, o braquiterapia.
- CPOM con ≤5 lesiones metastásicas positivas para PSMA en la PET/TC de PSMA con [68Ga]Ga-PSMA-11 o [18F]DCFPyL.*
- Al menos 1 lesión M1 positiva para PSMA según AJCC8 utilizando PET con PSMA.
- Estudios de diagnóstico por imágenes convencionales (IC) negativos para enfermedad M1.
- Todas las lesiones metastásicas deben ser susceptibles a SBRT.
- Nivel de testosterona sin castración >100 ng/dl.
- Tiempo hasta la duplicación del PSA < 10 meses.
- Ausencia de CPOM de nueva aparición, e inexistencia de pacientes que requieran TDA inmediata, según la evaluación del investigador.
- Ausencia de obstrucción concurrente e inmanejable del flujo de salida de la vejiga o incontinencia urinaria.

- Sin antecedentes de tratamiento previo con TDA, incluida la orquiectomía bilateral (se permiten participantes que recibieron RTX o PR y finalizaron la terapia adyuvante de TDA [o TDA + iARP] previo a la recurrencia si la última dosis de TDA [o TDA + iARP] fue antes de los 12 meses desde la aleatorización), otra terapia hormonal (se permite el ketoconazol a corto plazo durante < 28 días), radiofarmacéuticos, inmunoterapia, quimioterapia (excepto si se administra en el contexto [neo]adyuvante y se completa >12 meses antes de la aleatorización) o cualquier otro agente sistémico o en investigación para la enfermedad metastásica.

Para obtener más información sobre el diseño del estudio o la inscripción:
- Comuníquese con su representante médico local de Novartis.
- Visite clinicaltrials.gov para conocer criterios de elegibilidad adicionales.
Acrónimos:
A, aleatorización; AJCC8, Comité Conjunto Estadounidense sobre el Cáncer 8.a edición; BIRC, comité de revisión independiente a ciego; BPI-SF, Inventario Breve del Dolor - Formulario Abreviado; c/6 sem., cada 6 semanas; CP, cáncer de próstata; CPOM, cáncer de próstata oligometastásico; CVRS, calidad de vida relacionada con la salud; ECOG, Grupo Oncológico Cooperativo del Este; EQ-5D-5L, escala Europea de Calidad de Vida (EuroQoL) de 5 dominios y 5 niveles; FdT1, fin del tratamiento 1; FdT2, fin del tratamiento 2; F, flúor; FACT-P, Evaluación Funcional de la Terapia contra el Cáncer-Próstata; FACT-RNT, Evaluación Funcional de la Terapia contra el Cáncer-Terapia con Radionúclidos; Ga, galio; iARP, inhibidor de la vía de receptores de andrógenos; i.v., intravenoso; Lu, lutecio; M, metástasis; PET, tomografía por emisión de positrones; PR, prostatectomía radical; PSA, antígeno específico de próstata; PSMA, antígeno de membrana específico de próstata; RTX, radioterapia de haz externo; SBRT, radioterapia corporal estereotáctica; SEG, seguimiento; SG, supervivencia global; SLM, supervivencia libre de metástasis; SLP, supervivencia libre de progresión; SLPr, supervivencia libre de progresión radiográfica; TC, tomografía computarizada; TDA, terapia de deprivación de andrógenos.
*[177Lu]Lu-PSMA-617 también se conoce como lutecio (177Lu) vipivotida tetraxetano; [68Ga]Ga-PSMA-11 también se conoce como galio (68Ga) gozetotida; [18F]DCFPyL también se conoce como piflufolastat F 18. Consulte el prospecto del producto local correspondiente en relación con el/los uso(s) aprobado(s).
Referencias:
1. Datos de archivo. Estudio CAAA617D12302. Novartis Pharmaceuticals Corp; 6 de diciembre de 2023
2. ClinicalTrials.gov. Consultado el 8 de enero de 2024: https://clinicaltrials.gov/ct2/show/NCT05939414
El/los compuesto(s) se encuentran en fase de investigación o bien se están estudiando para nuevo(s) uso(s). No se han establecido la seguridad ni la eficacia y no existen garantías de que estarán disponibles comercialmente para el/los uso(s) actualmente en investigación.
Novartis de Colombia S.A. Calle 93B No. 16-31. PBX 654 44 44. Bogotá, D.C. Novartis de Colombia S.A. Novartis Pharma, AG de Basilea, Suiza. ® = Marca registrada. Material dirigido a médicos. Más información en el Departamento Médico de Novartis S.A Colombia: 6544444 o al correo electrónico: [email protected]. Si desea reportar un evento adverso ingrese al siguiente link: https://www.report.novartis.com/es o a través del correo electrónico: [email protected]. Este material no es promocional en lenguaje, apariencia o intención. Si se hace alusión a productos o indicaciones no aprobados por la autoridad regulatoria del país, será bajo el estricto propósito educativo, de genuino intercambio científico y para incluir las alternativas de tratamiento de forma balanceada, completa y vigente. Este material no pretende sustituir o reemplazar una decisión clínica ni terapéutica. No se autoriza la grabación, toma de fotografías y distribución del material, ni tampoco su difusión por medios no autorizados por Novartis. Fecha de aprobación: 23/oct/24. Fecha de caducidad: 23/oct/26. ID del contenido: FA-11295987.

