ADHERENCIA Y CALIDAD DE VIDA
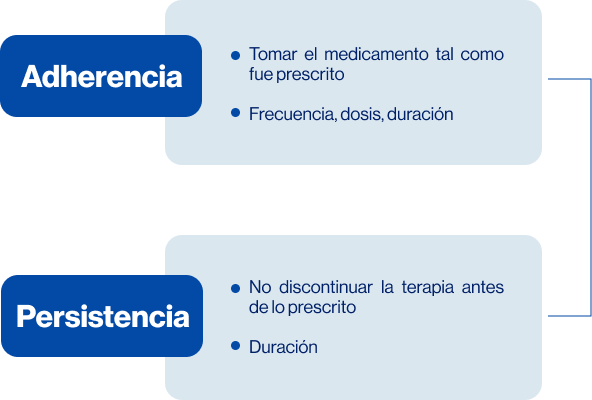
Se ha demostrado que la adherencia de los pacientes con cáncer de mama depende de múltiples factores que pueden estar relacionados con el sistema de salud, factores demográficos y clínicos del paciente tales como la edad y las comorbilidades, nivel educativo, la extensión y las características propias del tumor y las terapías administradas previamente (Figura 7).7
Figura 7. Definición adherencia y persistencia.
Fuente: Elaboración propia 8-11
La adherencia y la persistencia pueden influir tanto positiva como negativamente en los desenlaces de salud, en el caso de cáncer de mama con recurrencias y/o muerte. Se ha visto que incluso más del 75% de los pacientes descontinúan la terapia endocrina antes del tiempo establecido y alrededor del 50% toman la medicación de manera diferente a lo prescrito: cambian la dosis o frecuencia del medicamento (Figura 8).8-11
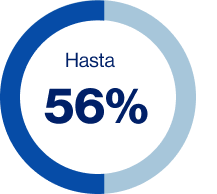
Pacientes no persistentes a los 5 años
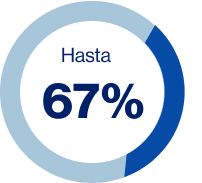
Pacientes con baja adherencia a los 5 años (Ej. Dosis saltadas, extras o reducidas)
Figura 8. Adherencia en pacientes con cáncer de mama que inician terapia endocrina adyuvante
Fuente: Adaptado de Yussof I, et al. Breast. 2022;62:22-35
Muchas veces la calidad de vida para estas pacientes toma una gran relevancia, algunos estudios han demostrado que los eventos adversos sintomáticos como la fatiga, diarrea o insomnio afectan la adherencia de los pacientes y llevan a descontinuación temprana de los tratamientos, esto también afectado por la gravedad del evento adverso.
Conoce aquí datos de calidad de vida del NATALEE
Los desenlaces para las pacientes mejorarán en cuanto garanticemos una mejor adherencia y persistencia en la toma de los medicamentos, y esta es una responsabilidad compartida entre los médicos, los pacientes y otros actores del sistema de salud.
Referencias:
- Lopez S., et al. (2022). Future Oncol, 18(8):1003-22.
- Slamon DJ., et al. (2023). Rationale and trial design of NATALEE: a Phase III trial of adjuvant ribociclib + endocrine therapy versus endocrine therapy alone in patients with HR+/HER2- early breast cancer. Ther Adv Med Oncol, 15:17588359231178125. doi: 10.1177/17588359231178125.
- Slamon DJ., et al. (s.f). Póster LBA500, presentado en ASCO 2023 [Oral].
- Slamon D., et al. (2019). J Clin Oncol, 37(15 suppl) [abstract TPS 597].
- Burris HA., et al. (2021). Br J Cancer, 125: 679-686.
- Hortobagyi G., et al. (2023). SABCS 2023. GS03-03 [Oral].
- Wulaningsih W., et al. (2018). Breast Cancer Res treat, 172:167-177.
- Paranjpe R., et al. (2019). Breast Cancer Res treat, 174:297-305.
- Murphy CC., et al. (2012). Breast Cancer Res treat, 134:459-478.
- Moon Z., et al. (2017). Patient prefer adherence, 11: 305-322.
- Hershman DL., et al. (2010). J Clin Oncol, 28: 4120-4128.
- Yussof I., et al. (2022). Breast, 62: 22-35.
- Chirgwin JH., et al. (2016). J Clin Oncol, 34: 2452-2459.
- Cardoso F., et al. (2022). ESMO breast. Poster 178p.
Material exclusivo para profesionales de la salud. Este material no puede ser modificado. Este material no es promocional en lenguaje, apariencia o intención. Si se hace alusión a productos o indicaciones no aprobados por la autoridad regulatoria local, será el bajo estricto propósito educativo, de genuino intercambio científico y para incluir las alternativas de tratamiento de forma balanceada, completa y vigente. Este material no pretende sustituir o reemplazar una decisión clínica ni terapéutica. Ribociclib está indicado para el tratamiento de pacientes con cáncer de mama RH+ HER2- en estadio IV en combinación con un inhibidor de aromatasa. Ribociclib no cuenta con aprobación por la agencia regulatoria local para uso en pacientes con cáncer de mama RH+HER2- estadio II o III. Novartis no recomienda su uso fuera de las indicaciones aprobadas. No se permite la grabación, reproducción, distribución, comunicación pública y/o modificación de contenido. Todo el contenido es propiedad de Novartis Pharma AG y está sujeto a protección de derechos de autor. Todos los datos sobre productos que no son de Novartis se basan en información disponible públicamente en el momento de la presentación. Si desea reportar un evento adverso ingrese al siguiente link: https://www.report.novartis.com/es o a través del correo electrónico: [email protected]. Mayor información en el Departamento Médico de Novartis S.A PBX 6544444 o en [email protected]. Fecha de aprobación: xxx Fecha de caducidad: xxx Content ID: xxx