NATALEE: EFICACIA
El segundo análisis interino con datos publicados en ASCO 2023, muestran un seguimiento a 27.7 meses en el cual el 20.2% de los pacientes había finalizado el esquema propuesto a 3 años de ribociclib, el 45% continuaba recibiendo ribociclib y el 77.8% continuaba recibiendo terapia con IANE.
En este punto de corte, la tasa de discontinuación reportada fue de 33.8% de los cuales un 18.7% correspondía con eventos adversos a diferencia de la tasa de discontinuación en el grupo control que fue de 24.2% (Figura 1).
Este análisis demostró una eficacia estadísticamente significativa en comparación con la TE sola, con un beneficio clínico absoluto del 3.3% en la supervivencia libre de enfermedad invasiva (iDFS) a los 3 años y una reducción del 25% en el riesgo de enfermedad invasiva (Figura 2).
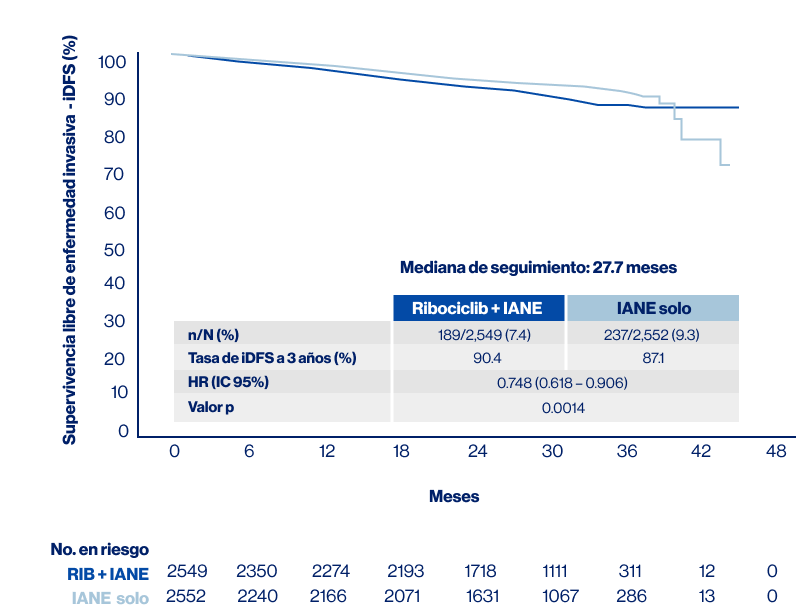
Figura 2. Supervivencia libre de enfermedad invasiva. Fuente: adaptado de Slamon DJ, et al. Póster LBA500, presentado en ASCO 2023 [Oral]. RIB: Ribociclib; IANE: Inhibidores de aromatasa no esteroidales; HR: Hazard ratio.
El beneficio observado con Ribociclib fue consistente en los subgrupos (Tabla 1):
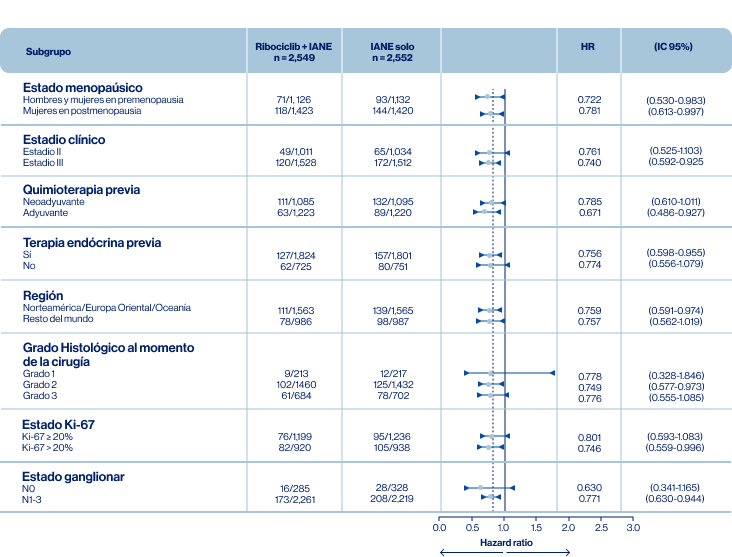
Tabla 1.Beneficio en iDFS por subgrupos Siglas: AJCC, American Joint Committee on Cancer; HR: Hazard ratio; Fuente: Adaptado de Slamon DJ, et al. Póster LBA500, presentado en ASCO 2023 [Presentación oral]
Dentro de los objetivos secundarios del estudio, se demostró un beneficio absoluto del 2.2% en la supervivencia libre de enfermedad a distancia (DDFS, por sus siglas en inglés), definida como el tiempo desde la aleatorización hasta la fecha del primer evento de recurrencia a distancia. Adicionalmente, se observó una reducción del riesgo del 26.1% (HR 0.739 [IC 95% 0.603-0.905]) en el grupo que recibió ribociclib. En cuanto a la sobrevida global (SG), se observó una tendencia de mejoría con un tiempo de seguimiento de 30.4 meses, aunque están planificados seguimientos adicionales para este desenlace.
Los eventos adversos reportados son consistentes con otros estudios previos de ribociclib. La principal causa de discontinuación de la terapia fueron los eventos adversos hepáticos (8.9% vs 0.1%) y artralgia (1.3% vs 1.9%). Finalmente, este análisis mostró que la mediana de discontinuación por eventos adversos ocurrió de manera temprana durante los primeros 4 meses.
En el ESMO 2023, se presentaron resultados del segundo análisis interno con datos recopilados hasta el 11 de enero de 2023. En ese momento, la media de seguimiento era de 27.7 meses para ambos grupos de tratamiento. Además, se mostraron resultados consistentes en la supervivencia libre de enfermedad invasiva (iDFS) para grupos clínicamente relevantes, como estadios anatómicos (II y III), el compromiso ganglionar (N0 y N1-N3), estado menopáusico y la edad (<65 años y ≥65 años).
Entre todos los subgrupos analizados, el beneficio para Ribociclib + IANE vs solo IANE fue consistente con el observado con la población ITT (HR, 0.748; IC 95%: 0.618-0.906; P=0.0014).
En este análisis se evidencia beneficio en iDFS para enfermedad en estadio II (HR, 0,761 [0.525-1.103]) y para pacientes en estadio III (HR, 0.740 [0.592-0.925]) y por compromiso ganglionar para pacientes N0 (HR, 0.630 [IC 0.341-1.165)]) y pacientes N1-N3 (HR 0.771 [IC 0.630-0.944]) (Figura 3).
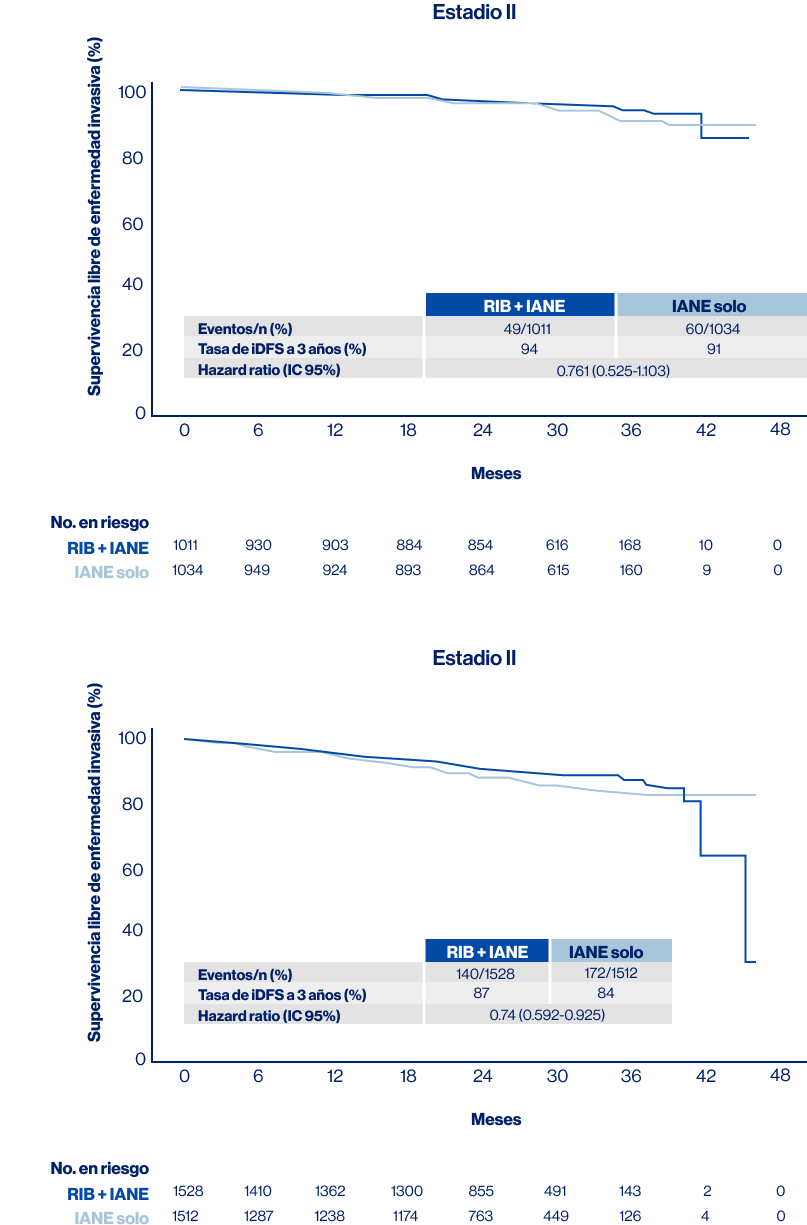
Figura 3. iDFS por estadio anatómico Fuente: modificado de Bardia A, et al. ESMO 2023. LBA23 [Presentación oral] RIB: Ribociclib; IANE: Inhibidores de aromatasa no esteroidales; HR: Hazard ratio; iDFS: supervivencia libre de enfermedad invasiva.
Por otro lado. se observó un beneficio consistente de iDFS para RIB + IANE frente a solo IANE para pacientes con enfermedad ganglionar negativa (HR, 0.630; IC del 95 %: 0.341-1.165) y en aquellos con enfermedad ganglionar positiva (HR, 0.771; IC del 95 %: 0.630-0.944) (Figura 4).
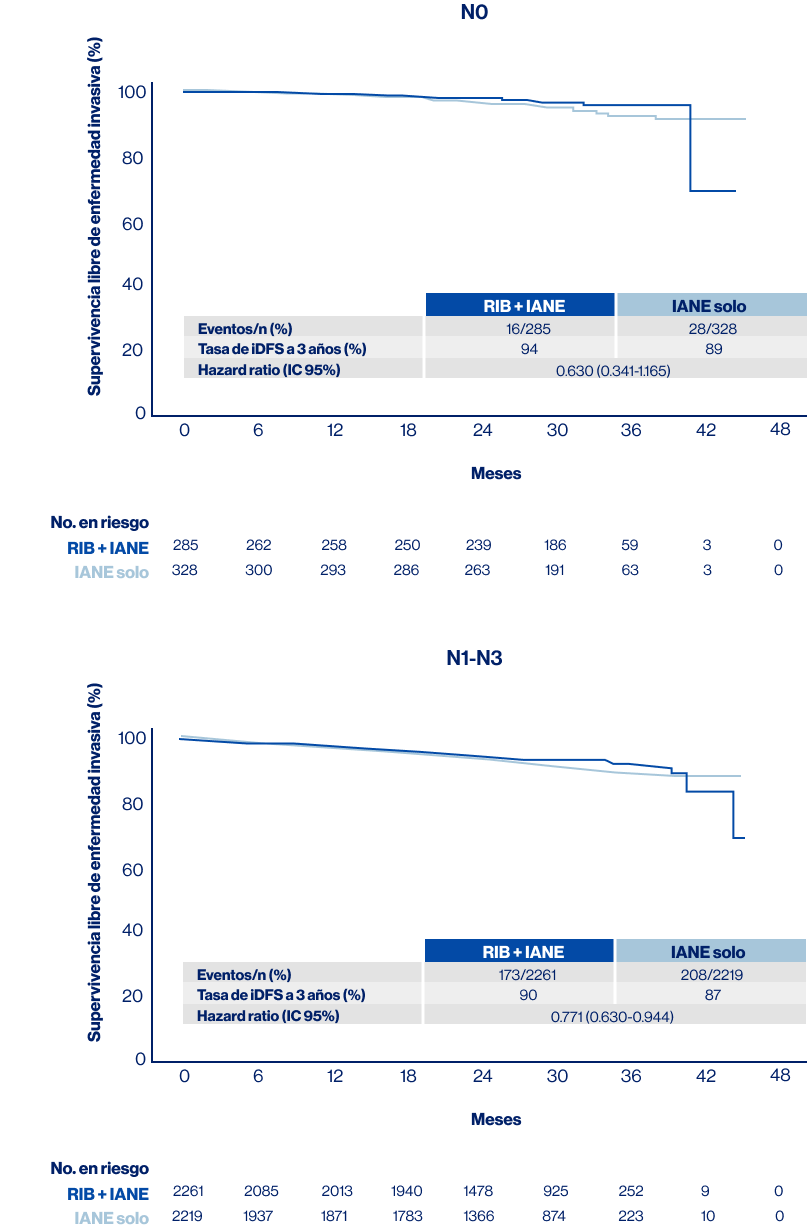
Figura 4. iDFS por Compromiso ganglionar Fuente: modificado de Bardia A, et al. ESMO 2023. LBA23 [Presentación oral] RIB: Ribociclib; IANE: Inhibidores de aromatasa no esteroidales; HR: Hazard ratio; iDFS: supervivencia libre de enfermedad invasiva.
Se observó un beneficio consistente de la iDFS para RIB + IANE en comparación con solo IANE entre:
En general, el beneficio de la iDFS en los subgrupos clínicamente relevantes preespecificados fue coherente con el observado en el estudio ITT y no estuvo influenciado por ningún subgrupo en particular. Los resultados respaldan aún más el uso de RIB + IANE como un nuevo tratamiento de elección en una amplia población de pacientes con cáncer de mama en estadios tempranos HR+/HER2−.
El análisis interno final se realizó con punto de corte al 21 de Julio de 2023 y con aproximadamente 500 eventos de iDFS, donde se evaluaron 33.3 meses de seguimiento (máximo 51 meses), representando 5.6 meses adicionales al análisis previo. Para este punto de corte el 42.8% de los pacientes había finalizado los 3 años de terapia con ribociclib, el 20.7% continuaba en tratamiento con ribociclib y el 75.1% continuaba en terapia con IANE (Figura 5).
La proporción pacientes que habían descontinuado el tratamiento fue del 35.5% de los cuales el 19.5% corresponde con discontinuación a causa de eventos adversos dentro de los cuales destacan los eventos adversos hepáticos y la artralgia.
En este análisis se demostró una eficacia clínica significativamente superior en comparación con TE sola con un beneficio absoluto en la supervivencia libre de enfermedad invasiva de 3.1% a 3 años y se mantiene un 25.1% de reducción en el riesgo de enfermedad invasiva, para este análisis el beneficio continúo siendo consistente en los subgrupos preespecificados (Figura 6).
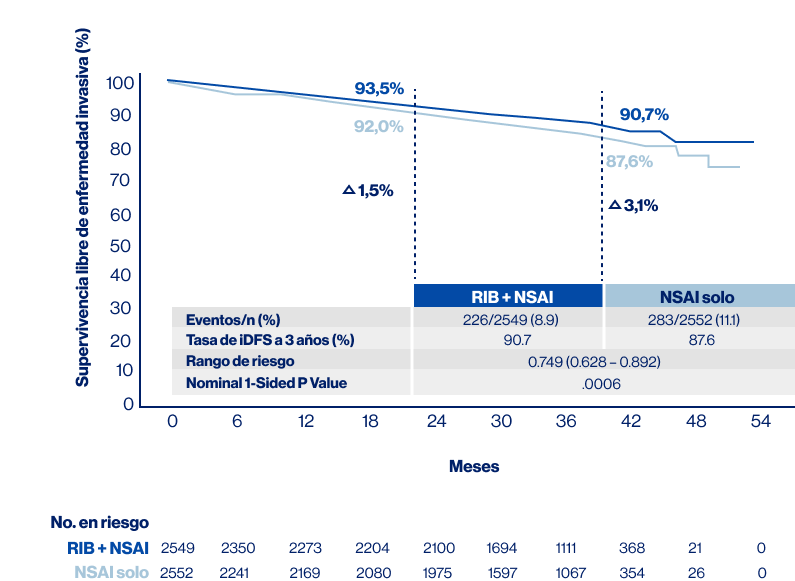
Figura 6. iDFS seguimiento a 33.3 meses Fuente: modificado de Hortobagyi G, et al. SABCS 2023. GS03-03 [Presentación oral] RIB: Ribociclib; IANE: Inhibidores de aromatasa no esteroidales; iDFS: supervivencia libre de enfermedad invasiva.
En este análisis se evidencia beneficio en iDFS para enfermedad en estadio II (HR, 0.700 [IC 0.496-0.986]) y para pacientes en estadio III (HR, 0.755 [0.616-0.926]) (Figura 7), representando una reducción del riesgo de enfermedad invasiva del 30% para estadio II y de 24.5% para estadio III con ribociclib + IANE en comparación con solo IANE.

Figura 7. iDFS por estadio anatómico Fuente: modificado de Hortobagyi G, et al. SABCS 2023. GS03-03 [Presentación oral] RIB: Ribociclib; IANE: Inhibidores de aromatasa no esteroidales; HR: Hazard ratio; iDFS: supervivencia libre de enfermedad invasiva.
Por otro lado, se observó una reducción de riesgo del 27.7% para pacientes sin compromiso ganglionar - N0 (HR, 0.723 [0.412-1.268)]) y del 24.1% en pacientes N1-N3 (HR 0,759 [IC 0.631-0.912]), con ribociclib + IANE en comparación con IANE solo.
Finalmente, para la supervivencia libre de progresión a distancia (DDFS por sus siglas en ingles), se observó un beneficio absoluto de 2.7% y una reducción de 25.1% de enfermedad distante con ribociclib + IANE en comparación con el grupo control a 3 años.
Estos resultados del análisis final del estudio NATALEE enfatizan el beneficio a 3 años en iDFS con el uso de ribociclib + IANE en comparación con solo IANE en una amplia población de pacientes con cáncer de mama temprano RH+/HER2- que se encuentran en riesgo de presentar recurrencias de la enfermedad.
Referencias:
- Lopez S., et al. (2022). Future Oncol, 18(8):1003-22.
- Slamon DJ., et al. (2023). Rationale and trial design of NATALEE: a Phase III trial of adjuvant ribociclib + endocrine therapy versus endocrine therapy alone in patients with HR+/HER2- early breast cancer. Ther Adv Med Oncol, 15:17588359231178125. doi: 10.1177/17588359231178125.
- Slamon DJ., et al. (s.f). Póster LBA500, presentado en ASCO 2023 [Oral].
- Slamon D., et al. (2019). J Clin Oncol, 37(15 suppl) [abstract TPS 597].
- Burris HA., et al. (2021). Br J Cancer, 125: 679-686.
- Hortobagyi G., et al. (2023). SABCS 2023. GS03-03 [Oral].
- Wulaningsih W., et al. (2018). Breast Cancer Res treat, 172:167-177.
- Paranjpe R., et al. (2019). Breast Cancer Res treat, 174:297-305.
- Murphy CC., et al. (2012). Breast Cancer Res treat, 134:459-478.
- Moon Z., et al. (2017). Patient prefer adherence, 11: 305-322.
- Hershman DL., et al. (2010). J Clin Oncol, 28: 4120-4128
- Yussof I., et al. (2022). Breast, 62: 22-35.
- Chirgwin JH., et al. (2016). J Clin Oncol, 34: 2452-2459.
- Cardoso F., et al. (2022). ESMO breast. Poster 178p.
Material exclusivo para profesionales de la salud. Este material no puede ser modificado. Este material no es promocional en lenguaje, apariencia o intención. Si se hace alusión a productos o indicaciones no aprobados por la autoridad regulatoria local, será el bajo estricto propósito educativo, de genuino intercambio científico y para incluir las alternativas de tratamiento de forma balanceada, completa y vigente. Este material no pretende sustituir o reemplazar una decisión clínica ni terapéutica. Ribociclib está indicado para el tratamiento de pacientes con cáncer de mama RH+ HER2- en estadio IV en combinación con un inhibidor de aromatasa. Ribociclib no cuenta con aprobación por la agencia regulatoria local para uso en pacientes con cáncer de mama RH+HER2- estadio II o III. Novartis no recomienda su uso fuera de las indicaciones aprobadas. No se permite la grabación, reproducción, distribución, comunicación pública y/o modificación de contenido. Todo el contenido es propiedad de Novartis Pharma AG y está sujeto a protección de derechos de autor. Todos los datos sobre productos que no son de Novartis se basan en información disponible públicamente en el momento de la presentación. Si desea reportar un evento adverso ingrese al siguiente link: https://www.report.novartis.com/es o a través del correo electrónico: [email protected]. Mayor información en el Departamento Médico de Novartis S.A PBX 6544444 o en [email protected]. Fecha de aprobación: xxx Fecha de caducidad: xxx Content ID: xxx





