RESULTADOS DEL ESTUDIO
NATALEE: EFICACIA
Los pacientes en el estudio NATALEE fueron aleatorizados 1:1 para recibir terapia con Ribociclib 400 mg día por 21 días durante 3 años + IANE (letrozol o anastrazol) de forma continua hasta completar >-5 años de tratamiento, en caso de tratarse de mujeres premenopáusicas o hombres, se añadió goserelina al esquema terapéutico a dosis de 3.6 mg una vez cada 28 días (Figura 1).
El grupo control recibió un IANE (letrozol o anastrazol) de manera continua por al menos 5 años y, en caso de mujeres premenopáusicas u hombres, Se administró goserelina (como agonista de hormona liberadora) para la hormona luteinizante a dosis de 3.6 mg, una vez cada 28 días.
- TE previa permitida hasta 12 meses
Estadio anatómico IIA
- N0 con:
- Grado 2 y evidencia de alto riesgo
- Ki-67 ≥ 20%
- Oncotype Dx Breasts Recurrence ≥ 26, o
- Grado 3
Estadio anatómico IIIB
- N0 o N1
Estadio anatómico III
- N0, N1, N2 o N3
N = 5.101

400mg/día
3 semanas/1 descanso
Letrozol o anastrazol ≥ 5 años
+ goserelina en hombres y mujeres premenopáusicas
Letrozol o anastrazol ≥ 5 años
+ goserelina en hombres y mujeres premenopáusicas
Desenlaces primarios
- Supervivencia libre de enfermedad invasiva (iDFS) por los criterios STEEP
Desenlaces secundarios
- Supervivencia libre de enfermedad distante
- Supervivencia libre de recurrencia
- Supervivencia global (OS)
- Resultados reportados por pacientes (HRQoL)
- Seguridad y tolerabilidad
- Farmacocinética
Desenlaces exploratorios
- Supervivencia libre de recurrencia locorregional
- Expresión genética y alteraciones en ctDNA/ctRNA
Figura 1. Diseño del estudio NATALEE
Adaptado de: Slamon DJ, et al. Ther Adv Med Oncol. 2023;doi: 10.1177/17588359231178125.
La estadificación se realizó al momento de la aleatorización de acuerdo con el estadio menopaúsico, uso previo de quimioterapia (neo)adyuvante y ubicación geográfica.
Ribociclib 400 mg
El perfil de seguridad y la eficacia de ribociclib a una dosis de 400 mg han sido demostrados ampliamente (Figura 2).
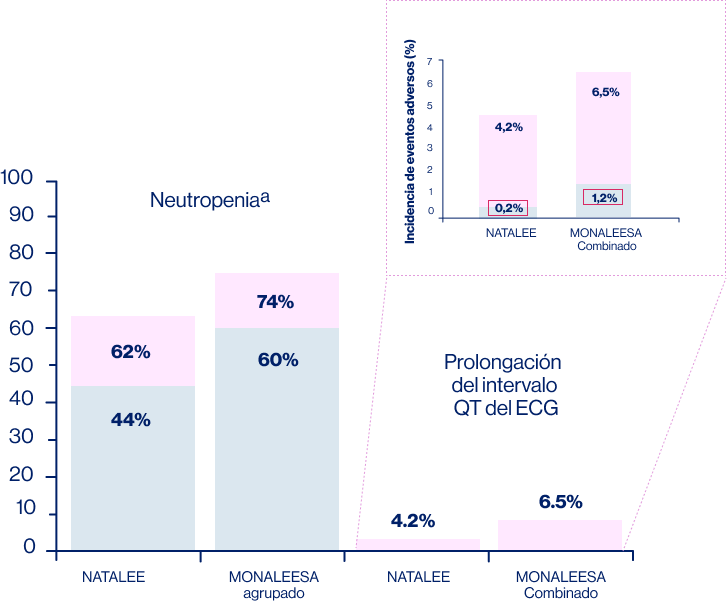
Grado ≥ 3
Todos los grados
El uso de ribociclib a 400mg ha demostrado una reducción significativa de eventos adversos dosis dependientes, principalmente neutropenia y ampliación del intervalo QT.
Figura 2.Eventos adversos de interés especial reportados en estudio NATALEE y MONALESSA
Figura adaptada de: Slamon D, et al. ASCO 2023. LBA 500 [Oral].
Referencias:
- Lopez S., et al. (2022). Future Oncol, 18(8):1003-22.
- Slamon DJ., et al. (2023). Rationale and trial design of NATALEE: a Phase III trial of adjuvant ribociclib + endocrine therapy versus endocrine therapy alone in patients with HR+/HER2- early breast cancer. Ther Adv Med Oncol, 15:17588359231178125. doi: 10.1177/17588359231178125.
- Slamon DJ., et al. (s.f). Póster LBA500, presentado en ASCO 2023 [Oral].
- Slamon D., et al. (2019). J Clin Oncol, 37(15 suppl) [abstract TPS 597].
- Burris HA., et al. (2021). Br J Cancer, 125: 679-686.
- Hortobagyi G., et al. (2023). SABCS 2023. GS03-03 [Oral].
- Wulaningsih W., et al. (2018). Breast Cancer Res treat, 172:167-177.
- Paranjpe R., et al. (2019). Breast Cancer Res treat, 174:297-305.
- Murphy CC., et al. (2012). Breast Cancer Res treat, 134:459-478.
- Moon Z., et al. (2017). Patient prefer adherence, 11: 305-322.
- Hershman DL., et al. (2010). J Clin Oncol, 28: 4120-4128
- Yussof I., et al. (2022). Breast, 62: 22-35.
- Chirgwin JH., et al. (2016). J Clin Oncol, 34: 2452-2459.
- Cardoso F., et al. (2022). ESMO breast. Poster 178p.
Material exclusivo para profesionales de la salud. Este material no puede ser modificado. Este material no es promocional en lenguaje, apariencia o intención. Si se hace alusión a productos o indicaciones no aprobados por la autoridad regulatoria local, será el bajo estricto propósito educativo, de genuino intercambio científico y para incluir las alternativas de tratamiento de forma balanceada, completa y vigente. Este material no pretende sustituir o reemplazar una decisión clínica ni terapéutica. Ribociclib está indicado para el tratamiento de pacientes con cáncer de mama RH+ HER2- en estadio IV en combinación con un inhibidor de aromatasa. Ribociclib no cuenta con aprobación por la agencia regulatoria local para uso en pacientes con cáncer de mama RH+HER2- estadio II o III. Novartis no recomienda su uso fuera de las indicaciones aprobadas. No se permite la grabación, reproducción, distribución, comunicación pública y/o modificación de contenido. Todo el contenido es propiedad de Novartis Pharma AG y está sujeto a protección de derechos de autor. Todos los datos sobre productos que no son de Novartis se basan en información disponible públicamente en el momento de la presentación. Si desea reportar un evento adverso ingrese al siguiente link: https://www.report.novartis.com/es o a través del correo electrónico: [email protected]. Mayor información en el Departamento Médico de Novartis S.A PBX 6544444 o en [email protected].
Fecha de aprobación: xxx Fecha de caducidad: xxx Content ID: xxx

